Database technieken waterzuivering en -behandeling
Elektrolyse
Principeschema
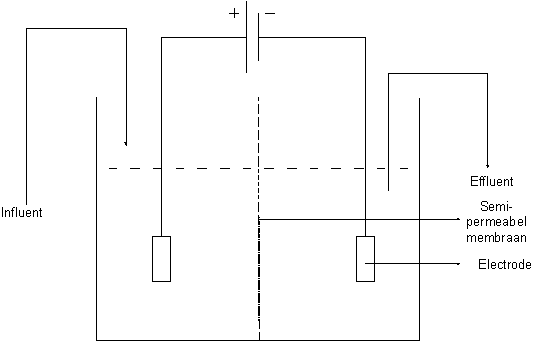
Principe- en installatiebeschrijving
Elektrolyse is het verschijnsel waarbij onder invloed van een elektrische stroom een doelgerichte elektronenoverdracht plaatsvindt in een elektrolyt[1], zodat chemische veranderingen worden geïnduceerd. Bij het proces wordt een vloeistof onder een elektrische gelijkspanning gezet met behulp van inerte elektroden en een spanningsbron. Door het toepassen van deze spanning op het afvalwater worden elektronen uitgewisseld tussen de elektroden en de vloeistof. De elektronen kunnen gebruikt worden om metaalionen om te zetten in vast metaal. Dit vast metaal zet zich af op de kathode. Het gereinigde afvalwater verlaat vervolgens de elektrolysecel en kan in veel gevallen hergebruikt worden. De methode is het best toepasbaar als slechts één metaalverontreiniging in de te behandelen vloeistof aanwezig is in een voldoende hoge concentratie.
De techniek wordt ook gebruikt voor chemische oxidatie/reductie en precipitatie toepassingen (zie technische fiche ‘Elektrocoagulatie‘).
De efficiëntie van de techniek kan verhoogd worden door de kathode- en anoderuimte te scheiden met behulp van een membraan. Het membraan is opgebouwd uit polymeer met hoge ladingsdichtheid. Door de lading van het membraan te wijzigen kan het anion- of kation selectief gemaakt worden. Deze scheiding laat toe de condities rond de elektroden afzonderlijk te optimaliseren (bv. pH correctie) waardoor nevenreacties vermeden worden en rendementen verhoogd.
Specifieke voor- en nadelen
Het voordeel van deze techniek is dat zowel het gezuiverde water als de neergeslagen metalen kunnen worden hergebruikt. Buiten metalen kunnen ook organische componenten via oxidatie en reductie door uitwisseling van elektronen afgebroken worden. Bij hergebruik van metalen mag slechts 1 metaalverontreiniging in voldoende hoge concentratie aanwezig zijn. Bij complexe mengsels is recuperatie van metaal en water moeilijk.
Door het gedeeltelijk oplossen van de gebruikte ‘inerte’anodes vermindert de kwaliteit van het teruggewonnen metaal. Het gebruik van een grafiet-anode kan hier uitkomst bieden. Het energieverbruik is hoog wanneer lage eindconcentraties nagestreefd worden. Aan de elektroden kunnen waterstofgas en chloorgas gevormd worden in aanwezigheid van (zout)zuur.
Toepassing
De voornaamste toepassing van elektrolyse bevindt zich in de metaalindustrie voor het opzuiveren van spoelwaters afkomstig van beitsbaden of van galvanische baden.
Bij deze toepassingen horen:
- terugwinnen van metalen en verbruikte elektrolyten;
- ontgiften van nitriet en Cr (VI) (zie ook technische fiche ‘Ontgiften‘);
- zilver terugwinning uit fixeerbaden in de grafische sector;
Door de uitloging van zware metalen in percolaatwaters is deze techniek ook geschikt als voorzuivering van dergelijke waters.
Als elektrolyse bij laag geconcentreerde oplossingen niet mogelijk is, worden conventionele technieken toegepast om de concentratie te verhogen, zoals ionenwisseling of membraantechnieken gevolgd door elektrolyseren van het regeneraat.
Een variatie van elektrolyse is membraanelektrolyse. Deze techniek vindt zijn toepassingen in o.a. de aanmaak van chloorgas, de oppervlaktebehandelingsector, standtijd verlenging van beitsbaden, terugwinning van EDTA, etc.
Randvoorwaarden
De ideale pH is afhankelijk van de toepassing. Nevenreacties zoals gasvorming of vorming van blauwzuur (HCN) bij cyanide dienen voorkomen te worden via pH correctie.
De verblijftijd in de elektrolysecel bedraagt tussen 5 en 30 minuten.
Werkingsgraad
Het zuiveringsrendement is meestal heel goed en bij de hoofdzuivering zijn eindconcentraties kleiner dan 0,1 mg/l mogelijk. Het behalen van die concentraties vereist echter de toepassing van speciale reactoren met een groot specifiek oppervlak en/of verbeterde stofoverdracht.
Bij het terugwinnen van Pd en Ni uit palladium-nikkellegeringsbaden wordt de concentratie aan beide metalen verlaagd tot 20 mg/l van beide. De restconcentratie van 20 mg/l kan dan verder teruggewonnen worden met behulp van andere technieken zoals ionenwisseling.
Een ander voorbeeld is de ontgifting van cyanides uit galvaniseerbaden. In deze toepassing worden restconcentraties van CN tot < 1 mg/l bereikt bij een ingangsconcentratie van bijvoorbeeld 5 g/l. De resterende concentratie kan verder gereduceerd worden met ionenwisseling.
Een andere belangrijke toepassing is elektrochemische chroom (VI)-ontgifting. Hierbij wordt ook gebruik gemaakt van een elektrolysecel waarbij er een reductie plaatsvindt van chroom (VI) naar chroom (III). Bij deze toepassing worden restconcentraties < 0,1 mg/l aan chroom (VI) gevonden. Belangrijk hierbij is de pH voorwaarden. Om een hoog stroomrendement (80 à 90 %) te realiseren dient de pH waarde kleiner dan 3 à 4 te blijven.
Hulpstoffen
Loog wordt gebruikt voor het vermijden van vorming van waterstofgas door H+-ionen. Zuur kan worden gebruikt voor pH aanpassingen om te vermijden dat metalen als hydroxide precipiteren alvorens neer te slaan op de elektrodes.
Milieu-aspecten
De afzet van het metaal op de elektrode vormt de reststof. Deze is mogelijks herbruikbaar. Loog en zuur zijn chemische hulpmiddelen waarvoor mogelijks een pH correctie moet gebeuren voor lozing.
Opmerkingen
Geen
Complexiteit
Het proces is vrij complex. Per terug te winnen metaal of organische component moet goed gekend zijn wat de mogelijke oxidatie/reductiereacties zijn. Hierbij is de soort elektrode tevens van belang.
Automatiseringsgraad
De automatiseringsgraad van elektrolyse wordt voornamelijk bepaald door de vereisten naar sturing van o.a. hulpmiddelen zoals pH-sturing en in-line meetapparatuur voor analyse van metaalionen en anionen.
[1] een waterige oplossing met ionen die stroom geleid
Versie
Februari 2010
Herziening augustus 2021
